ニュース
2016年09月09日
食事に応じた脂肪合成の遺伝子スイッチの仕組みを解明 治療へ前進

空腹時に肝臓での脂肪の合成を抑制し、食後に促進する遺伝子のスイッチ切り替えの仕組みが明らかになった。食事状況に応じて肝臓での中性脂肪の合成がオン・オフされる仕組みがはじめて解明された。
研究を発表したのは、筑波大学医学医療系の矢作直也准教授、武内謙憲助教らの研究グループ(筑波大学医学医療系ニュートリゲノミクスリサーチグループ)。
食事による遺伝子のスイッチをオン・オフする仕組みを解明
細胞の中の遺伝子の発現は、転写因子と呼ばれる遺伝子によって制御されている。「KLF15」は、脂肪細胞の分化に関わり、肥満状態の発現をコントロールするタンパク質。
研究チームは、「KLF15」が脂肪の合成に関与し、その発現を増強させると、血中の中性脂肪値が低下し、脂質異常症が改善することを突き止めた。
食事から過剰に摂取された炭水化物は、体内合成によってエネルギー貯蔵物質である中性脂肪に変えられ、脂肪組織などに蓄えられる。過食に伴い体内の中性脂肪が過剰になる状態が肥満で、糖尿病・高血圧・脂質異常症を併発しやすくなる。
これらは動脈硬化の危険因子でもあり、中性脂肪の合成・蓄積をコントロールする治療が求められている。
炭水化物から中性脂肪への合成・変換は食後に増加し、空腹時に減少する。この経路が食事状況に応じてどのように調節されているのかは不明だった。
そこで研究チームは、肥満のモデルマウスを使った実験で、肝臓で「KLF15」の発現を増強させると、血中の中性脂肪値が低下することを明らかにした。
in vivo(生体内)イメージング装置を用い、食事の摂取状況によって中性脂肪を合成する経路を制御する遺伝子「SREBP-1」を生きたマウスの肝臓内で可視化した。
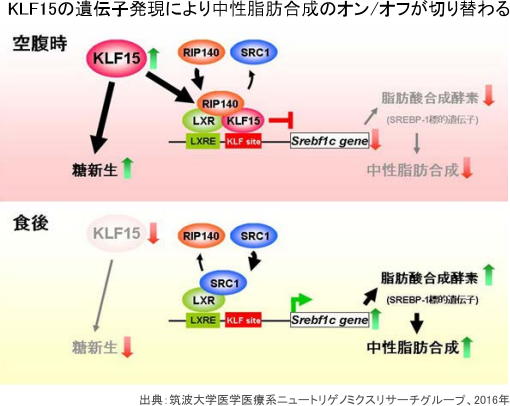
絶食時には肝臓の核内でSREBP-1のプロモーター(遺伝子発現に関与する領域)に「KLF15」を含むタンパク質複合体が形成され、この複合体が転写抑制因子を呼びこみ、SREBP-1の転写をオフにすることを突き止めた。これにより、絶食時には中性脂肪の合成が抑制されることが分かった。
一方、摂食後には同複合体から「KLF15」がなくなり、転写抑制因子が転写促進因子と入れ替わり、SREBP-1の転写をオンにすることが明らかになった。これにより、摂食後には中性脂肪合成が促進されるという。
また、肥満のマウスでは肝臓の「KLF15」の発現が低下しており、これを増加させると肥満マウスの高脂血症が改善することも判明した。治療的観点からも「KLF15」の重要性が明らかになった。
今回の研究は、2型糖尿病や肥満、脂質異常症の治療法の開発につながる可能性がある。成果は米科学誌「セル・リポーツ」電子版に発表された。
(代表者: 筑波大学医学医療系・准教授 矢作直也)
独自開発の新技術基盤によるニュートリゲノミクスの探求から代謝疾患の病態解明を目指し研究している。
[ Terahata ]
日本医療・健康情報研究所
医療の進歩の関連記事
- 糖尿病の人の足を守るために 気づかず進行する「足の動脈硬化(LEAD)」にご注意 日本初の研究を開始
- インスリンを産生するβ細胞を増やすのに成功 糖尿病を根本的に治す治療法の開発に弾み 東北大学
- 週に1回注射のインスリンが糖尿病治療を変える 注射回数を減らせば糖尿病の人の負担を減らせる
- 幹細胞由来膵島療法により1型糖尿病患者がインスリン不要に 新たな治療法の可能性
- インスリンを飲み薬に 糖尿病の人を注射から解放 画期的な研究成果を発表
- 【東京糖尿病療養指導士(東京CDE)】2023年度申込を受付中 講習会はeラーニング開催
- 1型糖尿病を「治る」病気に 最先端の研究を支援 日本IDDMネットワークが「サイエンスフォーラム」を開催
- CGMとインスリンポンプを組合せた「人工膵臓」 必要とするすべての糖尿病患者に提供するべき
- 運動が糖尿病を改善 わずか「1分間の運動」でも効果 仕事や家事の合間に行う簡単な運動に効き目が
- 1型糖尿病の発症を遅らせる薬を開発 米FDAが承認 1型糖尿病そのものの新たな治療法として期待

 医療・健康情報グループ検索
医療・健康情報グループ検索