ニュース
2020年07月06日
インスリンを自動的に放出する「人工膵臓」を開発 安価で安全性に優れ、血糖日内変動も抑制

名古屋大学や東京医科歯科大学などの研究グループは、インスリンの自律的に放出する機能をもった「人工膵臓」の開発に成功した。機械的構造をもたず(エレクトロニクスフリー)、タンパク質も利用しない(タンパク質フリー)仕組みになっている。安価で安全性に優れた「人工膵臓」の実用化へ向け前進した。
研究は、名古屋大学環境医学研究所/大学院医学系研究科の菅波孝祥教授、田中都講師、木村真一郎特任助教、東京医科歯科大学生体材料工学研究所の松元亮准教授、および奈良県立医科大学の桒田博仁助教を中心とする研究グループによるもの。
安全で使いやすい「人工膵臓」が求められている
糖尿病治療では現在、「どのようにして血糖値を下げるか」から「どのようにして糖尿病合併症を予防するか」ということに主眼がシフトし、低血糖を回避しながら血糖変動を改善する治療法が求められている。
インスリン頻回注射による治療法では、インスリン製剤の用法・用量や、食事や運動などとのバランスがうまくとれていないときに低血糖が起こることがある。重い低血糖は意識障害などの重篤な症状につながり、患者のQOL(生活の質)を大きく損なうおそれがある。
こうした課題を解決するために、インスリンポンプの普及も進んでいるが、患者に及ぼす負担や、機械特有の補正・メンテナンスの必要性、医療費などの課題もある。
そこで研究グループは、エレクトロニクス(機械や電気)駆動を必要とせず、血糖依存的に自律的にインスリンを放出する、新たな人工膵臓デバイスの開発に着手した。
血糖値の変化を検知して、自律的にインスリンを放出
過去の研究では、グルコースオキシダーゼやレクチンなどのタンパク質を基材とする試みがなされてきたが、生体由来の材料を使うのは限界があり、タンパク質変性にともなう不安定性や毒性などの課題があるため、実用化には至っていなかった。
研究グループは、この課題を解決するために、タンパク質を一切使用せず、グルコースに応答する性質を持つ「フェニルボロン酸」を主要な成分とする高分子ゲル(グルコース応答性ゲル)を作製し、人工膵臓デバイスの開発を進めてきた。
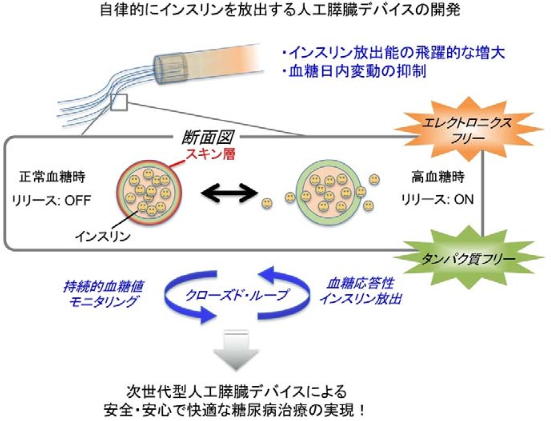
フェニルボロン酸は、血糖測定器のセンサーとして臨床応用されている。グルコースに反応して、その物理化学的性質を大きく変化させる性質があり、グルコース濃度が低い場合、フェニルボロン酸は脱水反応を生じて、ゲルの表面に「スキン層」と呼ばれる薄い脱水収縮層が形成され、インスリンの放出がオフになる。
逆にグルコース濃度が高い場合は、フェニルボロン酸は水和して「スキン層」は消失し、インスリンの放出がオンになる。
研究グループは、これを血糖値に応じたインスリン放出の制御機構として利用し、人工膵臓としての機能を付加することを考えた。
出典:名古屋大学環境医学研究所、2020年
クローズド・ループの「人工膵臓」デバイス
これまでの研究で、グルコース応答性ゲルとシリコンカテーテルを組み合わせて、世界初の「エレクトロニクス(機械)フリー」かつ「タンパク質フリー」な仕組みによる人工膵臓デバイスを作製し、マウスを用いてクローズド・ループ型デバイスの機能実証に成功している。
クローズド・ループは、血糖値を持続的にモニタリングし、その変動に応じて自律的にインスリン注入量を調整するシステム。
この研究では、血糖依存性のインスリン放出、低血糖時の安全性、3週間までの機能持続性、グルコースに対する特異的な応答性、糖尿病モデルでの良好な治療効果などが示された。
しかし、マウスとヒトの間には1,000 倍以上の体重差があるため、どのようにスケールアップをはかるかが大きな課題となっていた。
インスリン放出効率が飛躍的に向上
研究グループは今回の研究で、インスリン放出量がグルコース応答性ゲルの表面積に比例して増加するデバイスの開発を目指した。そして、血液透析用の中空糸と融合させた新たなデバイスの開発に成功した。
血液透析用中空糸は、半透膜でできたストロー状の細い管の集合体であり、半透膜の表面には、無数の孔が空いている(サイズバリア)。この中空糸をグルコース応答性ゲルでコーティングすることで、中空糸の全周をインスリン放出の有効面積として使用できるようになり、インスリン放出の能力が飛躍的に増大した。
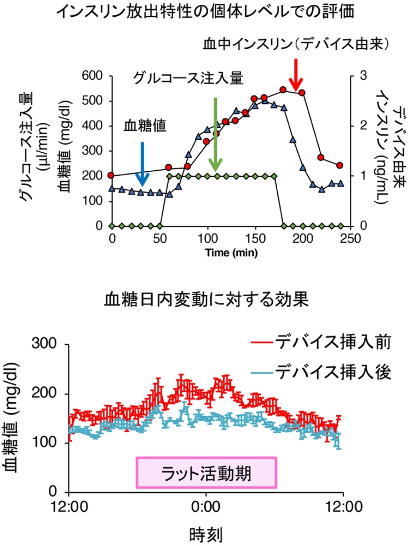
新たに開発したデバイスは、これまでのマウス用デバイスと同等のサイズで、体重が10倍のラットに対して有効であることを確認した。
血糖日内変動を抑制する効果を確認
出典:名古屋大学環境医学研究所、2020年
安価で負担の少ない「人工膵臓」の開発に向けて
開発したデバイスは、独自のグルコース応答性ゲルを応用することにより、低血糖のリスクが低く(血糖値変動に対するフィードバック機能)、操作が簡便であり(デバイスを皮下に留置するのみ)、安価で(エレクトロニクスフリーで構成)、低侵襲(血糖値センサーとインスリンポンプの機能を兼備)などの優位性がある。
今回の研究により、大幅なスケールアップ、温度耐性の向上、インスリン放出の数理モデル化、インスリン放出特性の個体レベルでの評価など、臨床応用に向けた課題の解決に成功した。さらに、血糖日内変動を抑制することも新たに確認した。
糖尿病治療の目標として、長期的な心血管合併症の予防が重視されている。これを達成するためには、平均血糖値を反映するHbA1cを指標とするだけでは不十分で、食後高血糖や血糖値の日内変動など血糖変動(血糖値スパイク)を抑える必要がある。
このデバイスを臨床応用できれば、1型糖尿病だけでなく、2型糖尿病(加齢や肥満などによりインスリン分泌が相対的に不足する糖尿病)も含めて、インスリン療法の早期導入を促し、糖尿病治療の戦略が大きく変えられる可能性がある。
「とくに簡便性や安全性により、被介護者や高齢者へのインスリン療法の普及に貢献でき、また、治療の自律性や低コスト性から、糖尿病患者の爆発的な増加が確実視される発展途上国でも有用性を期待できます」と、研究者は述べている。
研究は、日本医療研究開発機構(AMED)・産学連携医療イノベーション創出プログラム(ACT-M)、神奈川県立産業技術総合研究所、セコム科学技術振興財団、テルモ生命科学振興財団などの支援を受けて行われたもので、その研究成果は、国際科学誌「Communications Biology」に掲載された。
名古屋大学環境医学研究所Hollow fiber-combined glucose-responsive gel technology as an in vivo electronics-free insulin delivery system(Communications Biology 2020年6月17日)
[ Terahata ]
日本医療・健康情報研究所
医療の進歩の関連記事
- 糖尿病の人の足を守るために 気づかず進行する「足の動脈硬化(LEAD)」にご注意 日本初の研究を開始
- インスリンを産生するβ細胞を増やすのに成功 糖尿病を根本的に治す治療法の開発に弾み 東北大学
- 週に1回注射のインスリンが糖尿病治療を変える 注射回数を減らせば糖尿病の人の負担を減らせる
- 幹細胞由来膵島療法により1型糖尿病患者がインスリン不要に 新たな治療法の可能性
- インスリンを飲み薬に 糖尿病の人を注射から解放 画期的な研究成果を発表
- 【東京糖尿病療養指導士(東京CDE)】2023年度申込を受付中 講習会はeラーニング開催
- 1型糖尿病を「治る」病気に 最先端の研究を支援 日本IDDMネットワークが「サイエンスフォーラム」を開催
- CGMとインスリンポンプを組合せた「人工膵臓」 必要とするすべての糖尿病患者に提供するべき
- 運動が糖尿病を改善 わずか「1分間の運動」でも効果 仕事や家事の合間に行う簡単な運動に効き目が
- 1型糖尿病の発症を遅らせる薬を開発 米FDAが承認 1型糖尿病そのものの新たな治療法として期待

 医療・健康情報グループ検索
医療・健康情報グループ検索